1 月 14 日,我院陈绍兴课题组在《mBio》上发表题为《A protease-precursor system drives synergistic antagonism in haloarchaea》的研究论文,发现并揭示了嗜盐古菌协同拮抗现象形成的分子机制。
嗜盐古菌(haloarchaea)是生活于海边晒盐场、盐湖、盐碱地和盐矿等高盐环境的古菌类群。在营养相对匮乏的高盐环境中,嗜盐微生物为了争夺有限的生存空间和营养,普遍存在拮抗竞争的互作关系。目前,学者们一致认为分泌嗜盐菌素(halocin)是嗜盐古菌发挥拮抗活性的主要竞争策略。最近,随着地中海富盐菌胞外丝氨酸蛋白酶 HlyR4 参与形成抑菌活性物质的发现,两种古菌相互作用产生抑制第三方菌株的“协同拮抗(synergistic antagonism)”现象被首次报道,其背后的形成机制尚不清楚。
据此,我们对协同拮抗现象的形成提出以下假说:(1)协同拮抗现象的一方分泌胞外蛋白酶,另一方分泌无活性的前体蛋白;(2)无活性的前体蛋白在环境中受到蛋白酶的切割,产生具有抑菌活性的效应分子;(3)效应分子具有抑制其他第三方的活性。
本研究利用基因敲除、回补技术及体外异源表达手段,发现嗜盐古菌胞外丝氨酸蛋白酶能切割前体蛋白HFX_0892,产生0892C片段;0892C具有抑制包括Halorubrum属菌株在内的多种嗜盐古菌菌株的活性。该研究不仅揭示了嗜盐古菌形成协同拮抗现象的分子机制,也为后续基于蛋白酶切割蛋白/多肽的基础生物化学原理,筛选更多结构新颖、具有抑制临床耐药细菌活性的抗菌多肽提供了重要的理论依据。
研究团队首先发现,地中海富盐菌 EPS菌株与EPSR菌株之间可通过协同作用产生对Halorubrum sp. LN72菌株的抑菌活性(图1),这一现象即协同拮抗。研究人员利用同源重组基因敲除技术,敲除EPS菌株的胞外丝氨酸蛋白酶编码基因hlyR4后,协同拮抗现象随即消失,这表明蛋白酶HlyR4是EPS菌株参与协同拮抗的核心成分。通过琼脂分离、超滤浓缩和 SDS-PAGE技术,研究人员比较了协同拮抗区域与非协同拮抗区域的蛋白条带差异,发现一条明显的差异蛋白条带;随后将该条带切下送样进行高分辨率质谱分析,结果显示该蛋白条带为EPSR 菌株 HFX_0892 蛋白的C端肽段(下称0892C)。HFX_0892蛋白是否为前体蛋白、0892C是否为效应分子,当时尚不明确。
研究人员通过体外异源表达分别获得HlyR4蛋白与HFX_0892蛋白,并用二者分别替代EPS菌株和EPSR菌株,成功再现了最初在两菌株间观察到的协同拮抗现象。由此证实,EPS菌株与EPSR菌株在协同拮抗过程中分别提供了蛋白酶HlyR4和前体蛋白HFX_0892。随后,研究人员通过异源表达获得0892C和0892N片段,对二者分别进行抑菌活性测试后发现,仅0892N具有抑菌活性。这表明,此前发现的HFX_0892经HlyR4作用后产生的差异蛋白0892C并非效应分子,真正的效应分子为0892N。
为进一步解析效应分子0892N的功能结构域,研究人员利用AlphaFold3.0进行结构预测,发现0892N含有两个典型的α-螺旋结构。随后通过定点诱变技术破坏该α-螺旋结构,结果显示,α-螺旋结构的破坏会直接导致抑菌活性丧失。这表明,α-螺旋结构域是效应分子0892N发挥抑菌活性的关键功能结构域。
对嗜盐古菌这一协同拮抗现象形成机制的解析(图2),不仅为人们认识微生物复杂的相互作用模式提供了新视角,也为从极端环境中发掘新型抗菌活性物质奠定了重要基础。
bwin必赢线路检测已毕业硕士研究生王锐、孙思琪、郝育铃为共同第一作者,bwin必赢线路检测陈绍兴教授为唯一通讯作者。中国科学院微生物研究所韩静研究员参与部分工作并提出了宝贵建议。此外,丁悦、姜欣然、金雨、涂德梅、郑国英等人为该研究作出了贡献。该研究得到国家自然科学基金、安徽省自然科学基金、山东大学微生物技术国家重点实验室开放课题基金及安徽省高校分子酶学与分子检测省级创新团队项目的资助。
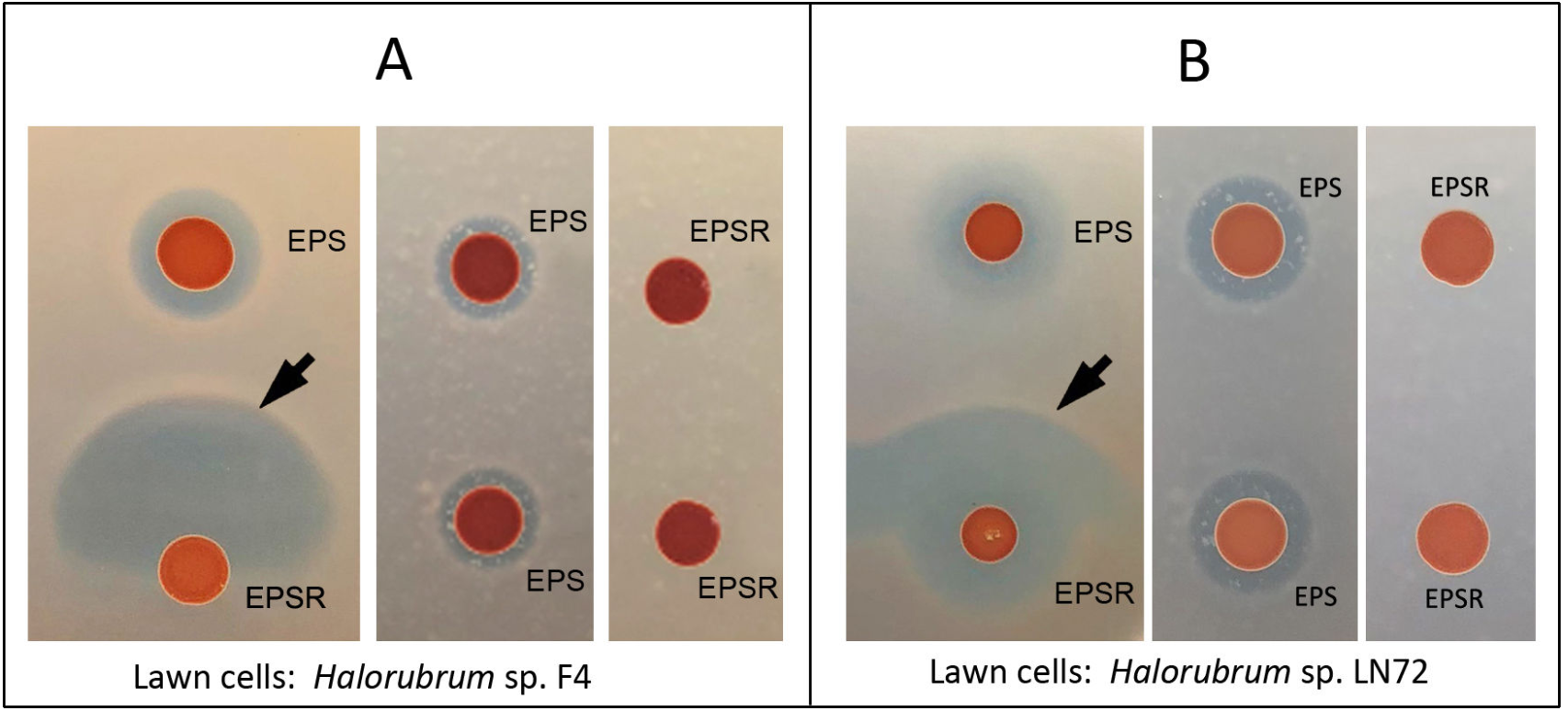
图1 嗜盐古菌协同拮抗现象的发现
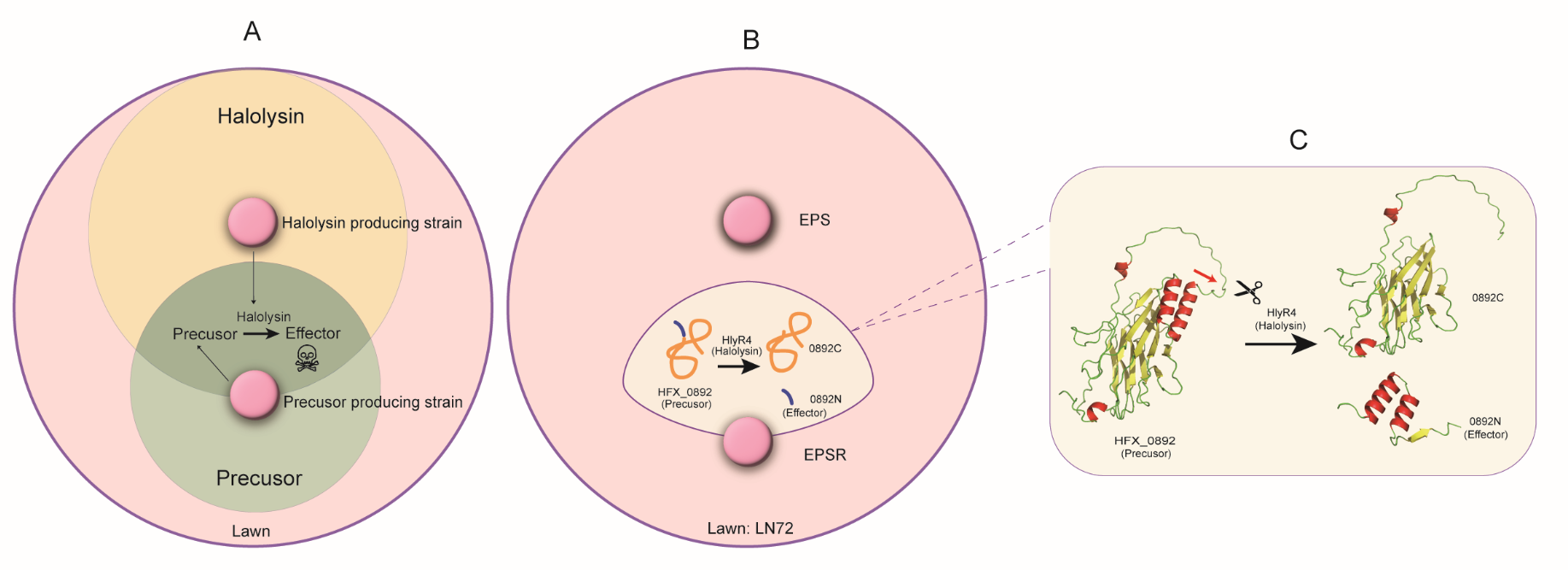
图2 嗜盐古菌协同拮抗分子机制解析模式图
全文链接:https://journals.asm.org/doi/10.1128/mbio.03405-25

